

Mardi 13 Avril 2021 – Édition « Actualités »
Sommaire
Les autres informations du mois
- Publication du décret relatif à la prévention des ruptures de stock nationales de médicaments
- Nomination de nouveaux membres de la commission de la transparence
- Campagne budgétaire 2021 des établissements de santé
- Actualisation du référentiel de certification des logiciels d'aide à la prescription hospitaliers
Notre focus
Analyse IQVIA en lien avec les nouvelles possibilités d’accès à un prix européen pour les ASMR IV
#Accord-cadre #Leem #CEPS
Le 5 mars 2021, a été signé, par Philippe Bouyoux, Président du Comité économique des produits de santé (CEPS) et Frédéric Collet, Président du Leem (Les entreprises du médicament), un nouvel accord-cadre applicable jusqu’au 5 mars 2024. Celui-ci succède à celui du 31 décembre 2015, initialement valable sur la période 2016-2018, puis finalement prorogé à quatre reprises jusqu’au 28 février 2021.
Ce nouvel accord-cadre, en cohérence avec les orientations données par les ministres au nouveau président du CEPS dans la lettre de mission du 19 février 2021, vise à répondre à 3 objectifs principaux, à savoir, permettre aux patients d’accéder rapidement aux innovations en prévoyant des procédures accélérées, contribuer à sécuriser la production de médicaments en France, et enfin simplifier les procédures d’accès au marché. En réponse à ces objectifs, plusieurs règles de fixation et de régulation des prix des médicaments ont été profondément révisées. Les principales mesures d’intérêt ont fait l’objet d’un focus par l’équipe du Club EChO dans l’édition Actualités du jeudi 11 mars 2021.
L’enjeu de l’accès à l’innovation est pris en compte à travers plusieurs mesures importantes, avec notamment un élargissement de l’accès à un prix facial hors taxe européen pour les produits ayant obtenu une amélioration du service médical rendu (ASMR) mineure (IV). Ainsi, l’article 11 défini qu’un produit ayant obtenu une ASMR IV pourra bénéficier d’un PFHT européen lorsque :
- « cette ASMR est définie par rapport à un comparateur bénéficiant d’une ASMR I à III obtenue depuis moins de 5 ans
- Ou qu’il ressort d’une analyse médico-économique qu’aux conditions de prix proposées le produit est dominant en termes d’efficience, en l’absence de réserve méthodologique majeure et de très forte incertitude ;
- Ou qu’elle satisfait un besoin médical non ou partiellement couvert au regard d’un nombre insuffisant de comparateurs dans l’avis de la Commission de la transparence [CT]. Le bénéfice d’un enregistrement accéléré et/ou d’un accès précoce peuvent étayer cette appréciation ;
- Ou qu’elle satisfait un besoin de santé publique au regard d’un nombre insuffisant de comparateurs ;
- Ou lorsqu’il s’agit d’un médicament antibiotique à base d’une nouvelle substance active (déjà présent dans le précédent Accord-cadre) ;
- Ou lorsqu’il s’agit d’un médicament orphelin ou qu’il s’agit d’une nouvelle spécialité associée dans une combo-thérapie ».
Afin de documenter l’impact de cette mesure et de caractériser les spécialités qui auraient été éligibles à un prix européen si les critères listés ci-dessus s’étaient appliqués, nous avons réalisé une analyse rétrospective des avis de la commission de la transparence et le cas échéant de la commission évaluation économique et de santé publique (CEESP) de la Haute Autorité de Santé, rendus en 2019 et en 2020, pour les médicaments ayant obtenu une ASMR IV en primo-inscription. A noter que la situation relative à la réponse à un besoin de santé publique n’a pu être analysée ; en effet, il est probable que la réponse à ce critère soit appréciée par les membres du CEPS. Les résultats de cette analyse sont présentés dans le Tableau 1.
Tableau 1 : Analyse rétrospective pour les médicaments ayant obtenu une ASMR IV en primo-inscription en 2019 et 2020.
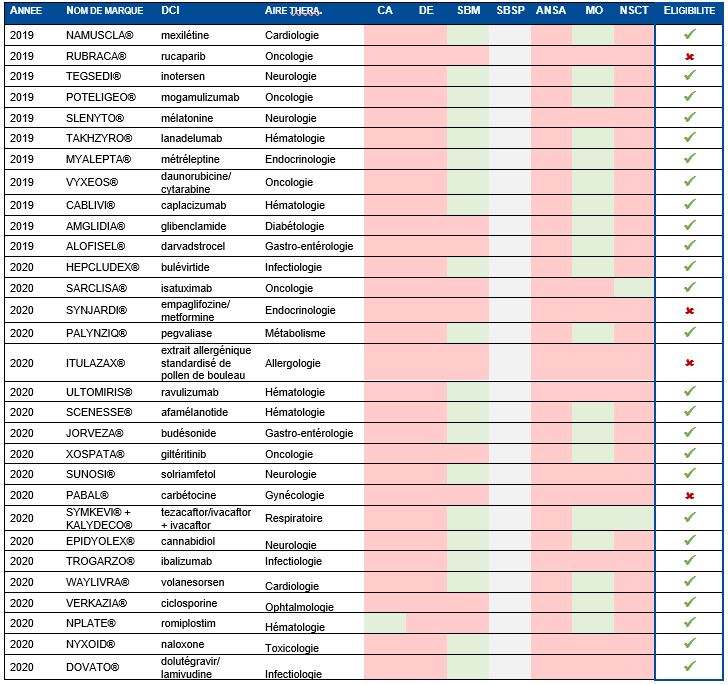
Légende : CA : ASMR est définie par rapport à un comparateur bénéficiant d’une ASMR 1 à 3 obtenue depuis moins de 5 ans, DE : Dominance en terme d'efficience en l’absence de réserve méthodologique majeure et de très forte incertitude, SBM : Satisfaction d'un besoin médical non/partiellement couvert au regard d’un nombre insuffisant de comparateurs, SBSP : Satisfaction d'un besoin de santé publique au regard d’un nombre insuffisant de comparateurs, ANSA : Antibiotique à base d’une nouvelle substance active, MO : médicament orphelin, NSCT : Nouvelle spécialité au sein d’une combo-thérapie.
L’analyse montre que 87 % (26/30 produits) des produits ayant obtenu une ASMR IV en primo-inscription entre 2019 et 2020 auraient été éligibles à un PFHT européen en répondant à 1 (37%) ou plusieurs critères (50%).
Les critères d’éligibilité les plus fréquents étaient un statut de médicament orphelin (63%, n=19 produits), et, la satisfaction un besoin médical non ou partiellement couvert au regard d’un nombre insuffisant de comparateurs dans l’avis de CT (67%, n=20 produits). Ce critère reposait quasi-systématiquement sur la notion de « réponse partielle » au besoin médical identifié, apportée par le médicament.
A noter que seuls 2 produits auraient été éligibles au regard d’une ASMR IV définie par rapport un comparateur bénéficiant d’une ASMR 1 à 3 obtenue depuis moins de 5 ans (n=1) ou à une nouvelle spécialité associée dans une combo-thérapie (n =1) (Figure 1).
Figure 1 : Eligibilité à un prix facial européen des médicaments ayant obtenu en primo-inscription une ASMR IV entre 2019 et 2020.
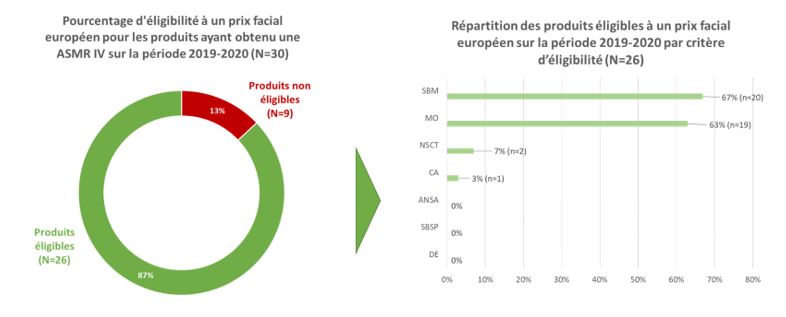
Légende : Le total des pourcentages de répartition par critère est différent de 100% car les produits peuvent répondre à plusieurs critères. A savoir, 15 produits répondent à plusieurs critères :
- 1 produit répondant aux 3 critères SBM, MO & NSCT (SIMKEVI®+KALYDECO®) ;
- 14 produits répondant à 2 critères, dont :
- 13 produits répondant aux 2 critères SBM & MO (NAMUSCLA®, TEGSEDI®, POTELIGEO®, TAKHZYRO®, MYALEPTA®, VYXEOS®, CABLIVI®, HEPCLUDEX®, PALYNZIQ®, SCENESSE®, JORVEZA®, EPIDYOLEX®, WALYVRA®), et ;
- 1 produit répondant aux 2 critères CA & MO (NPLATE®).
Les aires thérapeutiques les plus représentées parmi les produits éligibles étaient, par ordre décroissant, la neurologie (19%), l’hématologie (19%), l’oncologie (16%), la cardiologie (10%) et la gastro-entérologie (10%) (Figure 2).
Figure 2 : Répartition des produits éligibles à un prix facial européen sur la période 2019-2020 par aire thérapeutique (N=26).
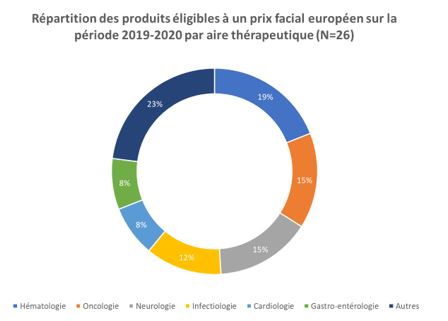
Légende : Autres (Endocrinologie, Diabétologie, Métabolisme, Respiratoire, Ophtalmologie, Toxicologie, soit 23% au total)
En définitive, les médicaments ayant obtenu une ASMR IV avec un statut de médicament orphelin ou la satisfaction un besoin médical non ou partiellement couvert au regard d’un nombre insuffisant de comparateurs dans l’avis de CT seraient les plus susceptibles d’être éligibles à un PFHT européen.
Toutefois, l’analyse des avis de CT relève que ce dernier critère est soumis à interprétation. D’une part, aucun avis de CT ne comprenait explicitement une telle formulation. D’autre part, le degré de satisfaction du besoin médical est également soumis à interprétation dans la mesure où l’analyse montre qu’aucun produit ne répond entièrement au besoin.
Notre sélection
Comptes de la sécurité sociale : solde en 2020 et évolutions après la crise de Covid-19
#Financessociales #Covid19 #HCFiPS
Le Haut Conseil du financement de la protection sociale (HCFiPS) a publié une note d’étape de sa réflexion sur les conditions de retour à un équilibre durable des comptes sociaux, dans le contexte induit par la crise de la Covid-19. Le Haut Conseil avait en effet été saisi en décembre dernier par le premier ministre, Jean Castex, pour assurer ce travail, dans la continuité du rapport du Haut Conseil de 2019 sur les lois de financement de la sécurité sociale.
La note reprend en préambule les éléments de contexte dans lequel s’inscrit cette réflexion : l’impact majeur de la crise sur les finances publiques en général, mais surtout sur les finances sociales ; la forte incertitude sur les perspectives économiques post crise de Covid-19 ; la nécessité de maintenir le cadre spécifique de pilotage et de gestion de la sécurité sociale, élément majeur du Pacte Républicain ; la challenge posé par les problématiques de soutenabilité mais aussi de cohérence des financements sociaux ; et enfin, le besoin d’assurer la compréhension par l’opinion publique des principes qui guident les politiques publiques.
Le Haut Conseil réaffirme sa vision de pilotage par les soldes pour éviter les transferts de dettes aux générations futures et préserver la confiance dans le système. Ce pilotage permet aussi d’assurer une cohérence et une lisibilité entre l’objet des dépenses et la nature des recettes. Le pilotage doit reposer sur un principe de responsabilité de chaque acteur pour financer sa politique en assurant l’équilibre de chacune des branches, et doit permettre de retrouver une trajectoire crédible de retour à l’équilibre des comptes sociaux.
Le Haut Conseil rappelle que le retour à l’équilibre est une opération complexe qui ne peut être envisagée que dans la durée. Cette durée a été fortement impactée par la crise de Covid-19. Les ministères de la santé et des finances viennent en effet de communiquer sur le solde du régime général de la sécurité sociale et du fonds de solidarité vieillesse 2020. Celui-ci s’établit à -38,6 Md€, en dégradation de 36,6 Md€ par rapport à 2019. Le solde 2020 est ainsi le plus déficitaire depuis les vingt dernières années. Il est cependant meilleur qu’anticipé, puisque la loi de financement de la sécurité sociale (LFSS) 2021 prévoyait un déficit de 49 Md€. La branche maladie est évidemment la plus affectée par la crise en raison de l’effet « de ciseau » : baisse des recettes et accélération des dépenses. Pour rappel, les dépenses 2020 intègrent également la première marche de valorisation du Ségur de la santé, pour plus d’1,4 Md€.
Figure 1 : Ventilation du solde Régime général + FSV par branche en 2019 et 2020
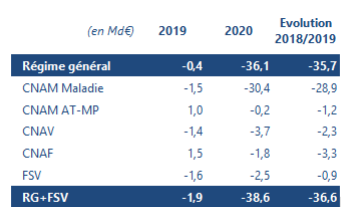
Légende : AT-MP : Accidents du travail – Maladies professionnelles, CNAF : Caisse nationale d’Allocations familiales, CNAM : Caisse nationale d’Assurance Maladie, CNAV : Caisse nationale d’Assurance Vieillesse, FSV : fonds de solidarité vieillesse, RG : régime général
Le Haut Conseil indique que le retour à l’équilibre implique d’avoir durablement une croissance des recettes supérieure à celle des dépenses, et insiste sur l’importance d’une transformation de la sécurité sociale dans une dimension davantage anticipatrice et préventive des risques sanitaires et sociaux. Cette approche serait sans doute la seule à même de conjuguer bien-être de la population et maîtrise des coûts des réparations futures, et repose sur une gestion plus transversale, notamment entre le social et le sanitaire, dans un décloisonnement des risques sociaux.
Progresser en matière de gouvernance de la protection sociale suppose aussi de poser une vision des finances sociales où la pluriannualité l’emporte sur l’annualité.Progresser en matière de gouvernance de la protection sociale suppose aussi de poser une vision des finances sociales où la pluriannualité l’emporte sur l’annualité.
Enfin, le Haut Conseil présente les résultats préliminaires de différentes simulations, selon les taux de croissance des dépenses et des recettes, l’amortissement de la dette sociale par la caisse d’amortissement de la dette sociale (CADES) ou non. Il apparait au Haut Conseil nécessaire, pour éviter l’aggravation permanente de la dette, de prioriser, pour les années à venir, le retour à l’équilibre des comptes courants plutôt que le remboursement rapide de la dette. Le Haut Conseil constate également qu’il ne sera pas possible de rééquilibrer l’assurance maladie rapidement par la seule maitrise des dépenses, même avec des hypothèses favorables. Les scénarios prenant les hypothèses les plus favorables (forte croissance du PIB, objectif national de dépenses d’assurance maladie (ONDAM) à 1,7%...) ne permettent pas d’envisager un retour à l’équilibre avant 2031.
Le Haut Conseil rappelle par ailleurs que les mesures prises lors de la dernière décennie pour maintenir un différentiel important entre progression des recettes et des dépenses, permettant de rétablir les comptes de l’assurance-maladie à un niveau acceptable, ne seront pas nécessairement réplicables compte tenu du contexte, ce qui complexifiera les futures stratégies de redressement des finances publiques.
Malgré la crise sanitaire, l’innovation médicale française se porte bien
#Innovation #Santé #Brevet
L’Office européen des brevets (OEB) a publié les statistiques de demandes de brevets en 2020. Malgré la pandémie, le nombre global de demandes de brevets européens déposées en 2020 (180 250 demandes) est presque égal à celui de l'année précédente, enregistrant une baisse de seulement 0,7 %.
Le domaine de la santé concentre 17% des demandes, avec 14 295 demandes pour les technologies médicales, 8 589 pour les produits pharmaceutiques et 7 246 pour les biotechnologies. Ces deux derniers secteurs affichent les plus fortes croissances 2020, avec respectivement +10,2% et + 6,3% par rapport à 2019. Le secteur des transports affiche quant à lui la plus forte baisse (-5,5%).
Figure 1 : Les 10 secteurs les plus actifs en 2020
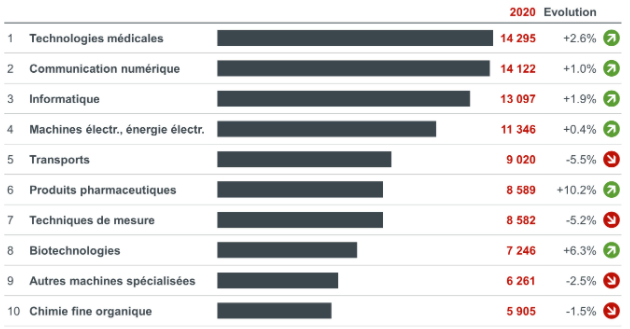
La France arrive au 5ème rang mondial avec près de 6% des demandes, derrière les Etats-Unis (25%), l’Allemagne (14%), le Japon (12%) et la Chine (7%).
A l’inverse de l’Allemagne qui affiche une évolution négative depuis l’an dernier (-3%), la France affiche une augmentation de 3,1% par rapport à 2019. Cette dynamique est principalement portée par les secteurs de la santé : produits pharmaceutiques (+21,8%) et technologies médicales (+17,5%).
Dans les secteurs de la santé, l’institut national de la santé et de la recherche médicale (INSERM) se classe au 1er rang des demandeurs pour les produits pharmaceutiques, avec 118 demandes de brevets, et au 2ème rang pour les biotechnologies, avec 72 demandes.
Lancement en 2021 des premières mesures de la stratégie décennale de lutte contre les cancers
#Inca #Stratégiedécennale #2021
L’institut national du cancer (Inca) a annoncé le lancement en 2021 d’un tiers des mesures de la stratégie décennale de lutte contre les cancers 2021-2030, définie par le décret n° 2021-119 du 4 février 2021, soit un total de 78 sur 234 mesures préalablement votées dont 65 qui seront directement déployées par l’Inca. Ces mesures entrent dans le cadre des quatre axes stratégiques de lutte contre le cancer à savoir améliorer la prévention, limiter les séquelles et améliorer la qualité de vie, lutter contre les cancers de mauvais pronostic et enfin s’assurer que les progrès bénéficient à tous.
En 2021, un budget de 118 millions d'euros sera dédié à la recherche qui occupe une place prépondérante dans cette stratégie. Dans ce cadre, de nombreux appels à projets seront lancés dont un appel à projets multithématiques dans le cadre de la prévention, visant à étudier les facteurs favorisant l’apparition d’un cancer (facteurs de risque et environnementaux). D’autres appels à projets seront axés autour de la prévention des séquelles (désescalade thérapeutique, reconstruction et qualité de vie), ou encore axés sur les cancers de mauvais pronostic et les cancers touchant l'enfant et le jeune adulte.
L’Inca prévoit dès 2021, en outre, le lancement d’un Programme d'actions intégrées de recherche (Pair) sur l’obésité et le risque nutritionnel. Ainsi, des essais cliniques, dont le portail sera régulièrement mis à jour, seront ouverts à tous et tout particulièrement aux populations vulnérables.
Une évaluation de la faisabilité de l'organisation d'un dépistage organisé dans le cancer du poumon est également prévue.
Par ailleurs, l’Inca a mis en place des mesures de lutte contre les pénuries de médicaments à travers « la réalisation de la preuve de concept intégrant sept molécules d'intérêt thérapeutique majeur » pour « identifier des zones de tension dans le processus de fabrication de ces médicaments afin de proposer des actions correctives ».
Dans la continuité de son activité, l’Inca procédera également à l'enrichissement de sa base de données en cancérologie en incluant de nouvelles données d’imagerie.
Enfin, d’autres mesures seront également mises en place autour de la lutte contre les « fakes news » et contre le renoncement aux soins lié au reste à charge ou encore autour d’e la détection et de l’étude de clusters de cancer.
Publication du décret relatif à la prévention des ruptures de stock nationales de médicaments
Dans le cadre du renforcement de la prévention et de la lutte contre les ruptures de stocks de médicaments (article 48 de la loi de financement de la sécurité sociale (LFSS) 2020), le décret du 30 mars 2021 qui rentrera en vigueur le 1er septembre, prévoit l’obligation pour les industriels de constituer des stocks nationaux de sécurité d’au moins 2 mois pour les médicaments d'intérêt thérapeutique majeur (MITM) et d’une semaine pour les autres spécialités. Alors que la LFSS 2020 prévoyait une obligation d’un mois pour toutes les spécialités non MITM, cette durée ne concerne plus que les médicaments contribuant à une politique de santé publique.
Dans le cadre des MITM, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) peut, dans certaines situations bien définies, et sur demande de l'industriel, décider de diminuer ce seuil. D’autre part, ce seuil peut être augmenté spontanément par l’ANSM jusqu’à un maximum de 4 mois, lorsque la spécialité fait l'objet de risques de ruptures ou de ruptures de stock réguliers dans les deux années civiles précédentes.
Enfin, ce décret précise que des plans de gestion des pénuries seront également requis pour les industriels.
Nomination de nouveaux membres de la commission de la transparence
Suite à la décision n° 2021.0060/SEM du 4 mars 2021 du collège de la Haute Autorité de santé, ont été nommés à la commission de la transparence, jusqu’au 9 novembre 2021 :
- En tant que membre titulaire, ayant voix délibérative :
- Madame Clémence BASSE en remplacement de Madame Sylvie CHEVRET.
- En tant que membres suppléants, ayant voix consultative :
- Monsieur Jean-Pierre BRU, en remplacement de Madame Nathalie CHABBERT-BUFFET ;
- Monsieur Jean-Christophe LEGA, en remplacement de Monsieur Antoine VANIER ;
- Monsieur Raphael FAVORY, en remplacement de Monsieur Yossi BONNAIRE ;
- Monsieur Francis BONNET.
Campagne budgétaire 2021 des établissements de santé
Les pouvoirs publics ont publié, le 31 mars, un arrêté détaillant les tarifs et montants forfaitaires des établissements de santé en tenant compte de l'impact financier de la Covid-19 et des revalorisations salariales accordées à la suite du Ségur de la santé. Il en ressort des gains de 0,2 % pour la médecine, chirurgie et obstétrique (MCO) et de 1,5 % pour l’hospitalisation à domicile (HAD) avec des taux d’évolution moyens des tarifs MCO de +7,5 % pour l'hôpital public et le privé non lucratif, de +6,4% pour les cliniques, et de +6,4 % pour les tarifs HAD. Les tarifs publiés ne tiennent pas compte du coefficient Ségur qui est de -0,19 % pour les hôpitaux, -1,38 % pour les établissements privés à but non lucratif, +0,28 % pour les établissements privés à but lucratif. Par ailleurs, la valeur du coefficient prudentiel reste inchangée soit 0,7 % pour tous les établissements et secteurs confondus (MCO, psychiatrie, soins de suite et de réadaptation (SSR)). Les évolutions tarifaires concernent également les tarifs des SSR (+2%), la psychiatrie (+2,8%), les enveloppes des forfaits annuels urgences (FAU) et forfaits activités isolés (FAI) (+8,6%), la dotation populationnelle des urgences (+11 %), l'enveloppe allouée au titre de l'incitation financière à l'amélioration de la qualité (Ifaq) (+50 millions d'euros) et l'enveloppe consacrée aux missions d'intérêt général et d'aide à la contractualisation (Migac) (+5,5 %).
Actualisation du référentiel de certification des logiciels d'aide à la prescription hospitaliers
Une mise à jour tenant compte de la nouvelle réglementation a abouti à l’actualisation du référentiel de certification des logiciels d'aide à la prescription (Lap) à usage hospitalier qui n’avait pas été modifié depuis son déploiement en 2012. Ainsi, 20 solutions ont été référencées comme certifiées au 9 mars 2021 avec la mise en consultation d’un référentiel actualisé par la HAS du 15 au 26 mars. L'objectif est d’améliorer les pratiques de prescription des médicaments et de garantir la conformité des logiciels à des exigences minimales notamment en termes de sécurité et d'efficience de la prescription.
Des évolutions sont également attendues à la publication des arrêtés relatifs aux décrets du 20 août 2019 et 25 août 2020 et en fonction du contexte technologique et réglementaire.
Une publication de l'équipe Real-World Insights Market Access / HEOR :
Romain Arini, Neïla Aoual Kazi, Delphine Bucher, Céline Coppo, Jocelyn Duhamel, Lou Dumon, Ariane Laulhé-Desauw, Camille Lebreton, Clément Le Dissez, François Morand, Laetitia Rey, Arnaud Troubat, Victor Vega
Retrouvez l'ensemble des expertises et domaines d'activité de notre équipe : Télécharger notre brochure

Copyright © 2025 IQVIA Holdings Inc. and its affiliates. All rights reserved. Privacy Statement
Conformément aux lois et règlements applicables, nous vous informons que vous disposez d’un droit d’accès, d’un droit de rectification, d’un droit à l’effacement, d’un droit à la limitation du traitement, d’un droit d’opposition pour des raisons tenant à votre situation particulière et, dans certains cas, d’un droit à la portabilité sur les données personnelles que vous avez fournies vous concernant. Vous disposez également du droit de définir des directives relatives au sort de vos données personnelles traitées par IQVIA en cas de décès. Vous pouvez exercer votre droit d’opposition sans motif et à tout moment. Vous pouvez nous adresser vos demandes d’exercice de droits en écrivant à IQVIA ou en adressant un courrier électronique à l’adresse suivante : donnees.personnelles@iqvia.com . Vous pouvez également vous adresser au délégué à la protection des données d’IQVIA à l’adresse eu.dpo@iqvia.com Vous disposez, par ailleurs, du droit d’introduire une réclamation auprès de la Commission Nationale de l’Informatique et des Libertés (CNIL), notamment sur son site internet www.cnil.fr.
Les données vous concernant ont pour responsable de traitement la société IQVIA Opérations France, société par actions simplifiée ayant son siège à Tour D2 - 17bis place des Reflets TSA 64567 - 92099 Paris La Défense Cedex, au capital social de 12 400 632,20 euros, 347 939 415 RCS Nanterre, code APE 7320Z, TVA n° FR93 347 939 415.